研究内容概説
細胞生化学研究室(長原研究室)では主に細胞死の一形態である、アポトーシスについて研究をしています。
アポトーシスとは、生命体を健全に維持する(これを恒常性の維持とよびます)ために、生命体の維持には必要なくなった細胞(例えば寿命を迎えたり、傷害を受けたりしてきちんと機能しなくなった細胞)に自ら消滅してもらうという、細胞自身にあらかじめ備わった現象です。アポトーシスが起きるきっかけは、細胞自らがアポトーシスを起こそうと判断することもありますし、別の細胞からアポトーシスを起こしなさいと命令を受ける場合もあります。私たち人間は、37兆個の細胞から成り立っていますが、人間を形成している細胞たちは個々が勝手気ままに生きている訳ではなく、互いの細胞が協調して生きていることで総体の人間が健やかに生きていられるということになります。
アポトーシスが正常に働かなくなると、結果として生命体は病気になるケースが多くなります。例えば、アポトーシスが起きにくくなると本来なら消滅するはずの、傷害をうけておかしくなった細胞(癌細胞)が増えて癌になったり、逆に、脳においてアポトーシスが起きやすくなるとアルツハイマー病などの病気を引き起こすことがわかってきています。人間の病気の約60%にアポトーシスの異常が関与しているとの説があるほど、私たちの恒常性の維持とアポトーシスには深い関係があります。
このようなアポトーシスの異常を防ぐことができれば病気の治療に役立つことから、アポトーシスはどのように引き起こされるのか、細胞内でのシグナルのやりとりを解明するための以下に示すようなテーマについて、生化学的、細胞生物学的、および分子生物学的なテクニックを用いながら研究をしています。
ミトコンドリアは、細胞内に存在する小器官の一つで、細胞内においてエネルギーの生産の役目を担っていますが、アポトーシスにおいても、重要な役割を担っています。また、近年になり、傷害されたミトコンドリアを生体膜に包み、リソソームと融合することで細胞内貪食・消去し細胞「生存」維持を図るオートファジーの一種、マイトファジーが生じることも明らかになりつつあり、ミトコンドリアは細胞の生と死に深く関与する小器官といえます。
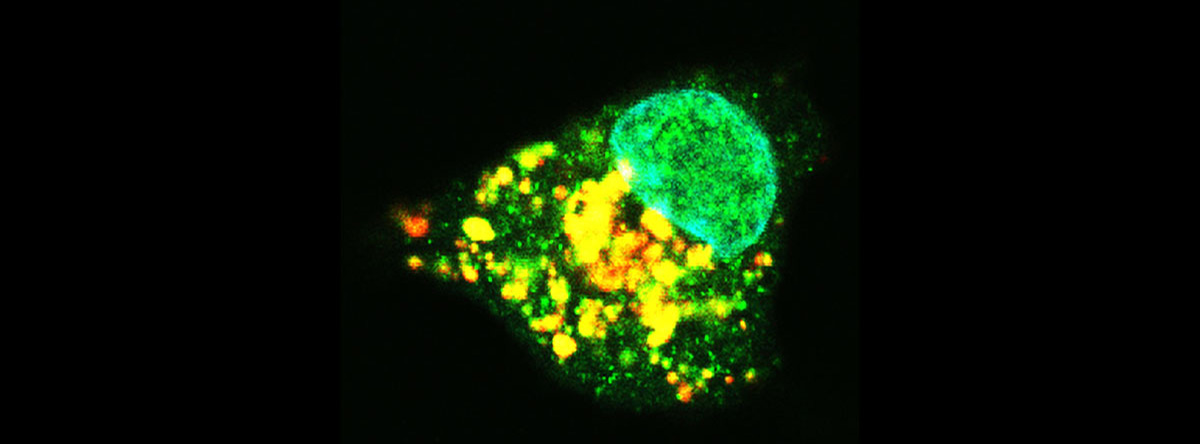
アポトーシスの特徴として、核の凝縮とそれに伴う細胞の形状変化がありますが、これらはアポトーシスの際に特異的に活性化する酵素群、カスパーゼが活性化することによる結果が主要因です。この、カスパーゼを活性化する一つの要因が、ミトコンドリア内に通常は存在して、エネルギー生産に関与する分子、シトクロムcの細胞質への放出です。放出されたシトクロムcは段階をへてカスパーゼを活性化させ、アポトーシスを進行させます。では、どのような物質がミトコンドリアからシトクロムcを放出させるのでしょうか。これまでに、ミトコンドリアに結合することによりシトクロムc放出を進行させる特殊なタンパク質(Bcl-2ファミリータンパク質)や酸化ストレスなどが明らかになっています。またBcl-2はアポトーシスおよびマイトファジーを抑制することが明らかになっていて、逆にBaxやBeclin-1はアポトーシスやマイトファジーを誘導することからBcl-2やそのファミリータンパク質はミトコンドリアに集積して傷害程度に応じて細胞死と生存のスイッチ切り替えを行っていると考えられます。
私たちはこれまでに、細胞内に存在する脂質やその類似物質がミトコンドリアに作用して、シトクロムcの放出を誘発させることを明らかにしてきました。そこでこの脂質によるミトコンドリアへのシグナル伝達機構を解明しております。ある特定の細胞のみをアポトーシスにより消去できるような化合物は抗癌剤や、免疫抑制剤としての応用が期待されます。また、癌細胞がいかにマイトファジーを引き起こすのを抑制するかも鍵になります。そこで、長原研究室では他研究室と共同して効果的にアポトーシスを誘導する薬剤の開発とその誘導機構の解明についても研究しています。
関連業績:
アポトーシスを起こした細胞は、貪食細胞と呼ばれる特殊な細胞(マクロファージなど)によって食べられます。このようなメカニズムがくるってしまうと、アポトーシス細胞が食べられずに残ってしまい、周囲の組織に炎症をおこしてしまいます。ということで、貪食細胞による、いらない細胞の除去は健康維持に重要です。この、アポトーシス細胞を中心とした貪食のメカニズム、および貪食細胞の貪食作用の向上について研究を進めております。
関連業績:
皮膚の角質層は角化細胞が分化した角質細胞と、その間を埋めている細胞間脂質から構成されていて、外部からの異物の侵入を防ぐバリア機能や水分保持機能が主な役割です。
一方アポトーシス時に活性化するカスパーゼはこれまでに14種類存在することが明らかになっていますが最近になって、カスパーゼ14は角化細胞に豊富に存在し、アポトーシスとは無関係にフィラグリン前駆体を分解して天然保湿因子をつくって、角質層のバリア機能、水分保持機能の維持に関与することが明らかになっています。つまり、カスパーゼ14を効果的に発現誘導、活性化させる化合物は、皮膚機能の改善につながることになります。そこで、カスパーゼ14の発現誘導を引き起こす物質の探索および機構を探ることで皮膚分化機構の解明を行っています。
関連業績: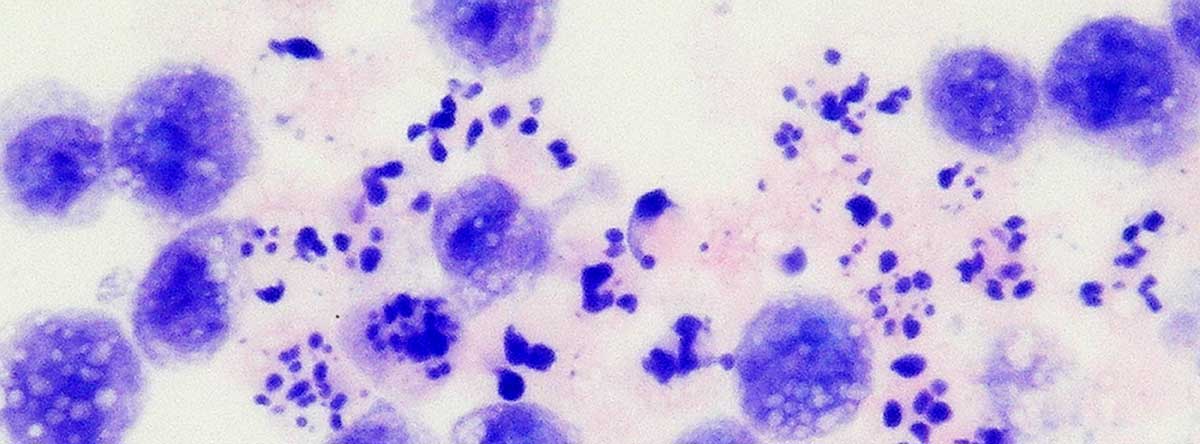
1.アポトーシス・オートファジー機構の解明
・Nagahara Y., Morita M., Nakata T., Iba A., Shinomiya T. Loss of Bcl-2 expression correlates with increasing sensitivity to apoptosis in differentiating ES cells. Cell Biol. Int., Vol. 38, No. 3, 381-387, 2014.
・Nagahara Y., Takeyoshi M., Sakemoto S., Shiina I., Nakata K., Fujimori K., Wang Y., Umeda E., Watanabe C., Uetake S., Yamori T., Dan S., Yoshimi Y., Shinomiya T., Ikekita M. Novel tamoxifen derivative Ridaifen-B induces Bcl-2 independent autophagy without estrogen receptor involvement. Biochem. Biophys. Res. Comm., Vol.435, No.4, 657-663, 2013.
・Nagahara Y., Suzuki E., Sekine Y., Uchiro H., Yoshimi Y., Shinomiya T., Ikekita M. SUTAF, a novel β-methoxyacrylate derivative, promotes neurite outgrowth with extracellular signal-regulated kinase and c-jun N-terminal kinase activation. Eur. J. Pharmacol., Vol.694, No.1-3, 53-59, 2012.
・Fukui M., Nagahara Y., Nishio Y., Honjo T., Shinomiya T. Induction of Mitochondria Defect and Caspase-dependent Apoptosis to human T-cell leukemia Jurkat cells by Rokitamycin. J. Pharmaco. Sci., Vol.110, No.1, 69-77, 2009.
・Nagahara Y., Shiina I., Nakata K., Sasaki A., Miyamoto T., Ikekita M. Induction of Mitochondria-Involved Apoptosis in Estrogen Receptor Negative Cells by a Novel Tamoxifen Derivative, Ridaifen-B. Cancer Sci., Vol.99, No.3, 608-614, 2008.
・Nagahara Y., Tanaka M., Shinomiya T. Mechanism of Mitochondrial 7A6 Antigen Exposure Triggered by Distinct Apoptotic Pathways: Involvement of Caspases. Cytometry, Part A, Vol. 71A, No.4, 232-241, 2007.
・Nagahara Y., Shinomiya T., Kuroda S., Kaneko N., Nishio R., and Ikekita M. Phytosphingosine induced mitochondria-involved apoptosis. Cancer Sci. Vol. 96, No. 2, 83-92, 2005. 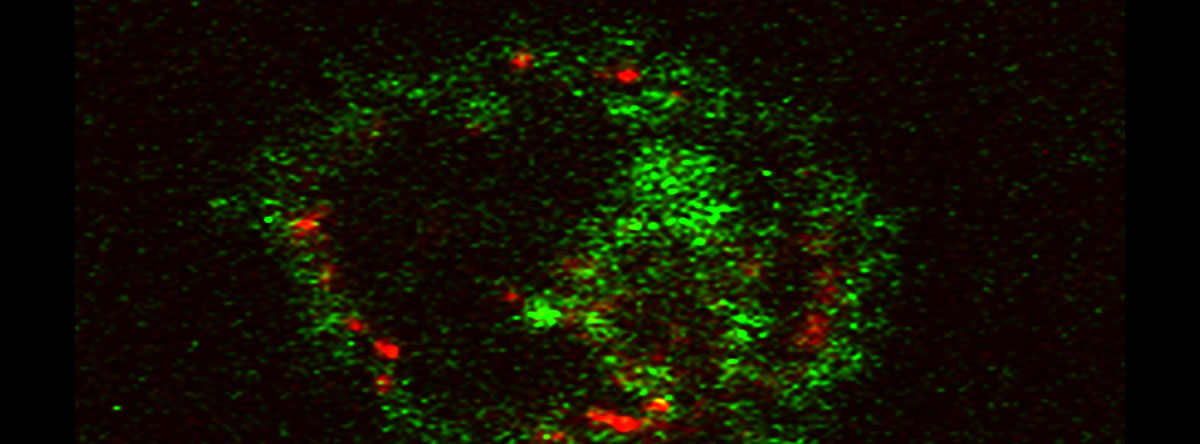
2.アポトーシス細胞貪食機構の解明
・Tamegai H., Takada Y., Okabe M., Asada Y., Kusano K., Katagiri Y.U., Nagahara Y. Aureobasidium pullulans culture supernatant significantly stimulates R-848-activated phagocytosis of PMA-induced THP-1 macrophages. Immunopharm. Immunotoxicol., Vol. 35, No. 4, 455-461, 2013.
・Nagahara Y., Nagamori T., Tamegai H., Hitokuwada M., Yoshimi Y., Ikekita M., Shinomiya T. Inulin stimulates phagocytosis of PMA-treated THP-1 macrophages by involvement of PI3-kinases and MAP kinases. Biofactors, Vol.37, No.6, 447-454, 2011. 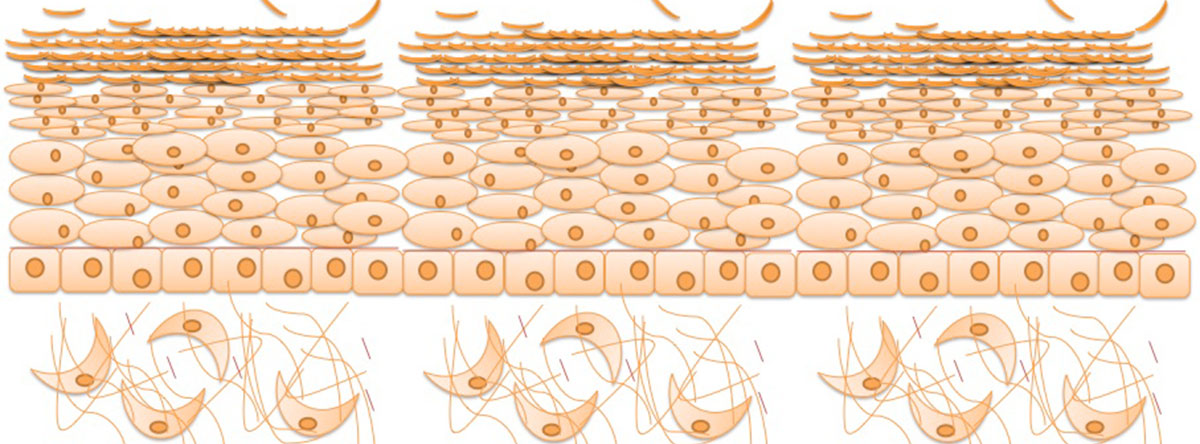
3.皮膚分化機構の解明
・Nagahara Y., Kawakami K., Sikandan A., Yagi D., Nishikawa R., Shinomiya T. Sphingoid base-upregulated caspase-14 expression involves MAPK. Biol. Pharm. Bull.,Vol. 41, No. 5, 743-748, 2018.